氧化钠化学式怎么写(金属及其化合物)
100次浏览 发布时间:2024-11-25 10:34:21
一,钠及其化合物之间的转化关系
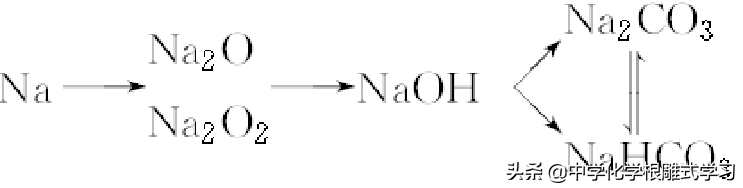
单质——氧化物——氢氧化物(碱)——盐
二,重要物质的性质
(1)钠(Na)——只具有还原性
①2Na+2H2O===2NaOH+H2↑
②2Na+2H2O+CuSO4===Na2SO4+Cu(OH)2↓+H2↑
注意:钠和盐溶液反应,不能置换出盐中的金属,而是先与H2O反应生成NaOH,然后生成的NaOH溶液再与盐溶液反应,钠与H2O、酸反应的实质都是与H+反应,所以钠与酸溶液反应更为剧烈。钠与熔融的盐反应才可能置换出盐中的金属。
③4Na+O2===2Na2O(空气中缓慢氧化)
④2Na+O2===Na2O2 (反应条件点燃)
⑤2Na2O+O2===)2Na2O2(反应条件加热)
注意:a.无论Na与O2反应生成Na2O或Na2O2,只要参与反应的Na质量相等,则转移电子的物质的量一定相等,但得到Na2O2的质量要大于Na2O的质量。
b.Na及其化合物发生焰色反应时火焰颜色均为黄色(焰色反应是元素的性质)。
c. Li和O2反应只生成Li2O:4Li+O2===2Li2O。(反应条件点燃)
(2)过氧化钠(Na2O2)——主要体现氧化性
①2Na2O2+2H2O===4NaOH+O2↑(歧化反应)
②2Na2O2+2CO2===2Na2CO3+O2(歧化反应)
③SO2+Na2O2===Na2SO4(过氧化钠具有氧化性,二氧化硫具有还原性)
注意:1 mol Na2O2参与反应转移电子的物质的量为1 mol(过氧化钠中氧为-1价,一个氧升高到0价,一个氧降低到-2价),但与SO2或H2SO3等的反应转移2 mol电子(过氧化钠中的氧全部降低到-2价)。过氧化钠中的电子转移数目常用在考查NA的题目中。Na2O2跟CO2和水蒸气组成的混合气体反应时,应先考虑Na2O2跟CO2的反应(二氧化碳是酸性氧化物),然后再考虑与水反应。Na2O2具有强氧化性,能将具有还原性的物质氧化,注意相关反应离子方程式的书写(如将Na2O2投入到Na2S、Na2SO3、NaI、FeSO4等具有还原性的溶液中),是地地道道的氧化还原反应。
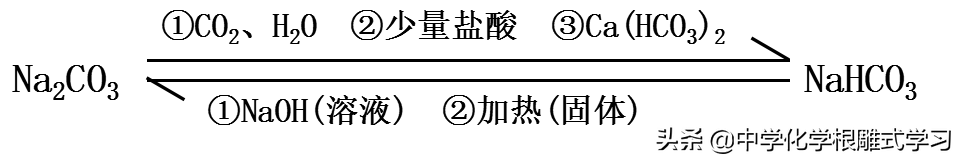
(3)碳酸钠(Na2CO3)——主要发生复分解反应
①Na2CO3+2HCl(过量)===2NaCl+CO2↑+H2O
②Na2CO3+HCl(不足)===NaCl+NaHCO3
③Na2CO3+CO2+H2O===2NaHCO3
④Na2CO3+Ca(OH)2===CaCO3↓+2NaOH
注意:以上反应本质是复分解反应,化合价不变。向Na2CO3溶液中加入盐酸时反应分两步进行,首先生成NaHCO3,然后是NaHCO3与盐酸反应生成CO2。二者滴加的顺序不同,产生的现象也不同,即存在互滴实验,这也是不用其他试剂就能鉴别出Na2CO3溶液和盐酸的原理。
(4)碳酸氢钠(NaHCO3)——主要发生复分解反应
①NaHCO3+HCl===NaCl+CO2↑+H2O
②NaHCO3+NaOH===Na2CO3+H2O
③2NaHCO3+Ca(OH)2(不足)===Na2CO3+CaCO3↓+2H2O
④NaHCO3+Ca(OH)2(过量)===CaCO3↓+NaOH+H2O
注意:
a.不能用常压下蒸发溶剂的方法制备NaHCO3晶体(因为碳酸氢钠不稳定受热可以分解),不能用澄清石灰水鉴别Na2CO3和NaHCO3,可以用氯化钙溶液或氯化钡溶液检验它们。
b.在书写碳酸氢盐与澄清石灰水反应的离子方程式时要特别注意二者量的相对多少。采用以少定多的方法书写。
c.吸收CO2气体中的HCl不能用饱和Na2CO3溶液,需要用饱和NaHCO3溶液洗涤除杂。
(5)氢氧化钠(NaOH)——具有碱的通性
①2NaOH+H2SO4===Na2SO4+2H2O
②CO2+2NaOH(过量)===Na2CO3+H2O
③CO2(过量)+NaOH===NaHCO3
注意:CO2与NaOH溶液反应的产物可能是Na2CO3、NaHCO3或二者的混合物,可根据Na+和C守恒法确定CO2与NaOH溶液的反应产物组成。
三,特殊变化及现象
(1)Li在空气中燃烧只生成Li2O。
(2)Na—K合金常温下呈液态,是原子反应堆的导热剂。
(3)鉴别Na、K利用焰色反应。
(4)碱金属的密度呈现增大的趋势,但K反常。
(5)向饱和的Na2CO3溶液中通入过量CO2,有晶体析出。
四,应用策略
1,金属钠与可溶性盐溶液反应的思路
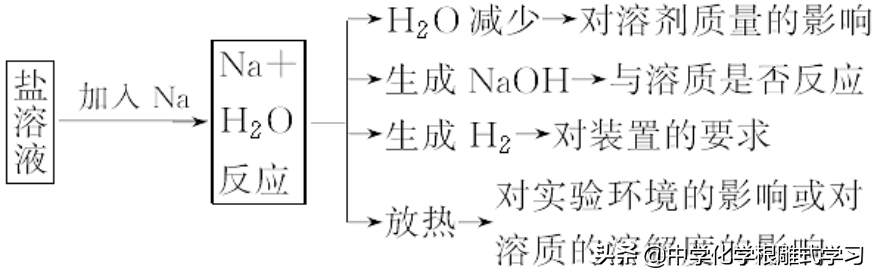
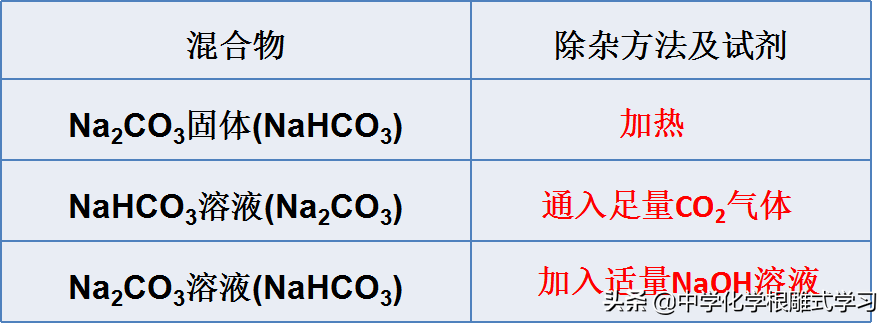
2,鉴别Na2CO3和NaHCO3的方法
(1)热稳定性不同

(2)和酸反应生成气体的速率不同(相同条件下)

(3)阴离子不同

(4)溶液的酸碱性
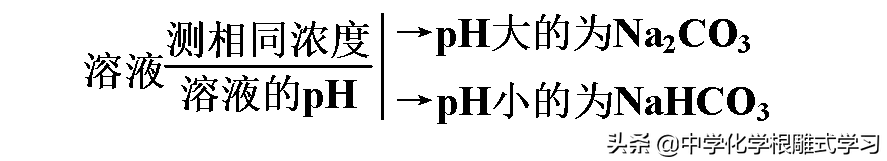
3,Na2CO3与NaHCO3的相互转化和除杂